Peter Mitchell fue un personaje excéntrico. Durante gran parte de su carrera trabajó en su propio laboratorio en una casa solariega restaurada en Cornwall, en el Reino Unido, y su investigación fue financiada en parte por su rebaño de vacas lecheras. Sus ideas sobre el proceso más básico de la vida —cómo se obtiene la energía— le parecía ridículo a sus colegas biólogos
 «Recuerdo que pensé que yo apostaría a que [la obtención de la energía] no funciona de esa manera», escribió el bioquímico Leslie Orgel sobre su reunión con Mitchell, hace medio siglo. «Desde Darwin y Wallace la biología no ha tenido una idea tan no intuitiva como las de, por ejemplo, Einstein, Heisenberg y Schrödinger».
«Recuerdo que pensé que yo apostaría a que [la obtención de la energía] no funciona de esa manera», escribió el bioquímico Leslie Orgel sobre su reunión con Mitchell, hace medio siglo. «Desde Darwin y Wallace la biología no ha tenido una idea tan no intuitiva como las de, por ejemplo, Einstein, Heisenberg y Schrödinger».
En las décadas siguientes, sin embargo, quedó claro que Mitchell tenía razón. Su reivindicación fue completa cuando ganó un premio Nobel en 1978. Incluso hoy en día, sin embargo, la mayor parte de los biólogos no han comprendido aún las implicaciones de sus revolucionarias ideas, especialmente sobre el origen de la vida.
«Las ideas de Mitchell eran sobre cómo se organizan las células en el espacio, y la generación de energía celular es una función de eso», dice Mike Russell, geoquímico del Jet Propulsion Laboratory de la NASA en Pasadena, California. «El problema es que la mayoría de las ideas sobre el origen de la vida no tienen en cuenta la organización espacial y el suministro de energía que maneje la reproducción o el crecimiento.»
Unos pocos investigadores, entre ellos: Russell, han estado replanteando el origen de la vida a la luz de las ideas de Mitchell. Creen que la mayoría de los rasgos no intuitivos de la vida dan las mejores pistas de su origen. Como resultado, han llegado con una imagen radicalmente diferente de lo que era la vida primitiva y donde se desarrolló. Es una imagen para la cual hay cada vez más pruebas.
Antes de Mitchell, todo el mundo suponía que las células obtienen su energía con una química sencilla. La moneda de energía universal de la vida es una molécula llamada ATP. Se la abre y se libera energía. El ATP alimenta la mayor parte de la energía que demandan los procesos en las células, desde la construcción de las proteínas a mover los músculos. A su vez, se pensaba que el ATP se genera a partir de los alimentos por una serie de reacciones químicas estándar. Mitchell pensaba lo contrario. La vida, argumentó, no es impulsada por el tipo de química que ocurre en un tubo de ensayo, sino por una especie de electricidad.
La energía de los alimentos, decía, se usa para bombear iones de hidrógeno con carga positiva, o protones, a través de una membrana. Como los protones se acumulan de un lado, se va acumulando un gradiente electroquímico a través de la membrana. Cuando se presenta la oportunidad, los protones regresan, liberando energía que se aprovecha para ensamblar moléculas de ATP. En términos de energía, el proceso es análogo a llenar un alto tanque con cubos de agua, y luego de usar el agua para que gire una noria.
Mitchell denominó «quimiosmosis» a su teoría, y no es de extrañar que los biólogos la encontraran difícil de aceptar. ¿Por qué la vida va a generar energía de manera tan compleja e indirecta, cuando serían suficientes las reacciones químicas simples? Simplemente no tiene sentido.
Puede ser no intuitiva, pero la quimiosmosis ha resultado omnipresente en el mundo de los seres vivos. La fuerza de los protones mueve no sólo la respiración celular, sino también la fotosíntesis: la energía del Sol se convierte en un gradiente de protones de una manera que es esencialmente la misma que lo que pasa con la energía de los alimentos.
Y los gradientes de protones a menudo se aprovechen directamente, en lugar de ser utilizados para producir ATP. Impulsan la rotación de los flagelos de las bacterias, así como el transporte activo de numerosas sustancias dentro y fuera de las células. Así que el poder de los protones es fundamental para la generación de energía, movimiento, y para mantener el ambiente interno; algunas de las funciones más básicas de la vida.
Esto sugiere que la energía de los protones no es una innovación tardía, sino que evolucionó bien al principio de la historia de la vida, una idea respaldada por el árbol de la vida. La primera rama del árbol se ubica entre los dos grandes grupos de células simples, las bacterias y las arqueas. Ambos grupos tienen bombas de protones, y ambos generan ATP a partir de las corrientes de protones, utilizando una proteína similar. La explicación obvia es que este mecanismo fue heredado de un ancestro común, el progenitor de toda la vida en la Tierra.
Piense acerca de las propiedades de ese ancestro común, dice Bill Martin, de la Universidad de Dusseldorf, en Alemania, y llegará a una bestia muy extraña. Él parte del supuesto de que lo más probable es que las características encontradas tanto en archaea y como en las bacterias sean heredadas de un ancestro común de toda la vida, aunque algunas han sido claramente adquiridas, posteriormente, por un intercambio de genes. Caminos distintos, presumiblemente evolucionados de forma independiente.
No hay duda de que el ancestro común procesaba ADN, ARN y proteínas, tenía un código genético universal, ribosomas (las fábricas de producción de proteínas), ATP y una enzima impulsada por protones para la fabricación del ATP. Los detallados mecanismos para la lectura de ADN y la conversión de los genes en proteínas también estaban allí. En resumen, entonces, el ancestro común de toda la vida se ve muy parecido a una célula moderna.
Y las diferencias son sorprendentes. En particular, el mecanismo detallado de la replicación del ADN habría sido muy diferente. Parece como si la replicación del ADN hubiese evolucionado en forma independiente en bacterias y arqueas, de acuerdo a Eugene Koonin en el Centro Nacional de Información sobre Biotecnología, en Bethesda, Maryland.
Más allá de eso, muchas vías bioquímicas son catalizadas por enzimas muy diferentes. Lo más sorprendente y más importante de esto es la fermentación, la producción de energía a partir de los alimentos sin oxígeno. A menudo se supone que la fermentación es el método primordial de generación de energía. Sin embargo, Martin ha demostrado que las enzimas responsables son totalmente independientes en las archaea y en las bacterias. Parecería como si la fermentación hubiese evolucionado dos veces y más tarde, en lugar de en los albores de la vida.
Límites desconcertantes
Aún más desconcertante, dice Martin, es que ni las membranas celulares, ni las paredes de las células tengan detalles en común. «A primera vista, los límites que definen a las células evolucionaron de forma independiente en bacterias y en archaea», dice.
Pero si ese es el caso, ¿qué clase de célula era este ancestro común? ¿Una célula sin paredes? ¡Imposible! ¿Algo único? Si se excluye lo imposible, entonces lo que queda debe ser la verdad.
Si Martín tiene razón, el ancestro común de la vida en la Tierra era una entidad sofisticada en términos de sus genes y proteínas, y se alimentaba con las corrientes de protones en lugar de con la fermentación. Sin embargo, al mismo tiempo, sus membranas eran, al parecer, diferentes a cualquier cosa que exista hoy día. Era vida, pero no como lo conocemos.
Alrededor de 2002 Martín conoció la obra de Russell. Hasta ese momento, Russell había sido una voz solitaria. Sus ideas geoquímicas sobre el origen de la vida no iban bien con los biólogos moleculares que dominaban el campo.
Desde principios de los 90, Russell exploró las posibilidades de un tipo muy particular de ventiladeros hidrotérmicos, a los que se les llama ventiladeros alcalinos, conocidos ahora gracias a los restos que se encuentran en rocas antiguas. A diferencia de las negras fumarolas descubiertas en 1977, formadas por la violenta reacción del agua de mar con lava volcánica que brota de las dorsales oceánicas, los ventiladeros de Russell eran muy mansos, poco más que piedras llenas de burbujas y plagadas de laberínticos poros.
Estos respiraderos se formaron cuando el agua reaccionó con el mineral olivino, común en el fondo del mar, y habrían sido aún más comunes al principio, antes de que la corteza terrestre se espese. El proceso produce un nuevo mineral, llamado serpentina, y libera hidrógeno, fluidos alcalinos y calor. También hace que las rocas se agranden y agrieten, permitiendo que más agua se filtre hacia abajo, lo que mantiene la reacción. Los cálidos efluentes, ricos en hidrógeno, en última instancia rompen a través del fondo del mar como un respiradero hidrotérmico alcalino.
El interés en los respiraderos alcalinos aumentó en 2000, cuando Deborah Kelley y sus colegas de la Universidad de Washington en Seattle tropezaron (si se puede tropezar en un sumergible) con un campo de fumarolas activas alcalinas cerca de la dorsal atlántica, exactamente donde Russell dijo que debían estar esos ventiladeros. El equipo denominó el lugar como «Ciudad Perdida» (Lost City), en parte por las espectaculares torres de roca que se forman cuando los carbonatos se precipitan desde el líquido alcalino.
Al igual que los respiraderos antiguos, las torres de la Ciudad Perdida están plagado de pequeños poros, algunos con dimensiones no muy diferentes a las células modernas. Y la química se ajusta a la teoría, también. Un informe del año pasado confirmó la presencia de metano y otros hidrocarburos pequeños, así como el propio hidrógeno (Science, vol 319, p 604).
Los ventiladeros pueden ser los mismos que los de alrededor de 4.000 millones de años atrás, pero en aquel entonces los océanos eran muy diferentes. Los océanos primordiales estaban saturados de dióxido de carbono, lo que los hacía ácidos, mientras que los mares hoy en día son ligeramente alcalinos. Y prácticamente no había oxígeno. Sin oxígeno, el hierro se disuelve fácilmente: las grandes formaciones en de hierro de todo el mundo nos revelan la cantidad de hierro que se disolvió en los océanos. Cuando los niveles de oxígeno crecieron lentamente, miles de millones de toneladas de hierro precipitaron en forma de óxido.
Lo que significa, dice Russell, que la interfaz entre los ventiladeros alcalinos y los antiguos mares habría sido mucho más favorable para la bioquímica primordial de lo que son hoy. En particular, se habrían formado burbujas de minerales de hierro-azufre —que tienen notables propiedades catalíticas— en los poros. Esto no es una conjetura. Russell ha encontrado respiraderos antiguos con una estructura similar, e incluso los reprodujo en el laboratorio.
El hecho de que los respiraderos alcalinos habrían tenido un laberinto de microcompartimientos formados naturalmente es lo que atrajo la atención de Martin. Estos compartimentos podrían haber sido los precursores de las paredes celulares biológicas que él estaba buscando, proporcionando un andamio en el que se podría formar el contenido de las células. Juntos, Russell y Martin han señalado que todavía se pueden encontrar idénticos minerales de hierro-azufre en el núcleo de las proteínas que convierten el dióxido de carbono en azúcares —utilizando gas de hidrógeno— en arqueas y bacterias como los metanógenos y acetógenos.
Los fluidos de los respiraderos contenían compuestos de nitrógeno como el amoniaco, y condiciones que favorecián la producción de aminoácidos, los bloques de construcción de las proteínas.
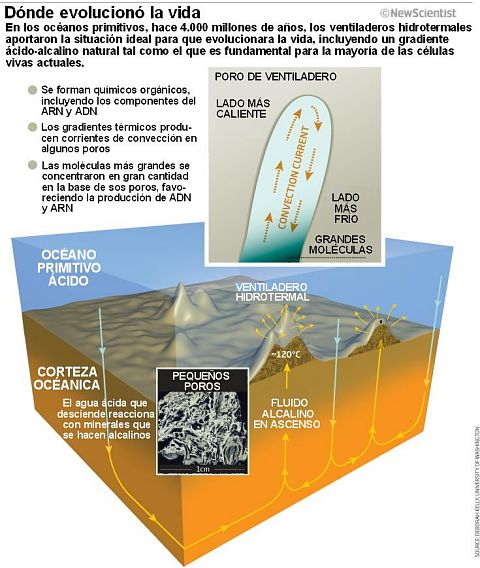
Eso no es todo. En presencia de fosfato, los minerales podrían haber catalizado la producción de nucleótidos, los bloques de construcción del ARN y ADN. Y si los nucleótidos se formaron por catálisis mineral, los poros en los ventiladeros alcalinos habrían tenido un extraordinario efecto.
Simulaciones por el equipo de Dieter Braun en la Universidad Ludwig Maximilian de Munich, Alemania, muestran que el gradiente de temperatura entre la parte superior e inferior de los poros concentra nucleótidos en un extremo, lo que fomenta que las moléculas se unan para formar cadenas de ARN y ADN (véase el diagrama). Estas moléculas de mayor tamaño pasarían a concentrarse en niveles aún más altos. Es más, las corrientes de convección producirían un continuo aumento y caída de temperatura, algo que se usa ahora para fabricar ADN en laboratorios de todo el mundo.
El mundo de ARN
Los experimentos de laboratorio hechos por un equipo dirigido por el Premio Nobel Jack Szostak de la Universidad de Harvard, publicados a principios de este año, han confirmado que estas condiciones en efecto concentran nucleótidos y ácidos nucleicos. El equipo también encontró que se concentran ácidos grasos, dando lugar a una formación espontánea de burbujas parecidas a células en el interior de los poros.
Es difícil imaginar un mejor escenario para el mundo del ARN que, como se piensa ampliamente, fue el que cerró la brecha entre los productos químicos orgánicos simples y la complejidad del ADN y las proteínas. Así que la idea de que los antiguos respiraderos hidrotermales alcalinos fueron los incubadores de la vida parece muy plausible, incluso antes de considerar su característica más llamativa: un gradiente de protones ya «servido».
En aquel entonces los mares eran ácidos, y la acidez se define en términos de protones: los ácidos son ricos en ellos. «Los fluidos alcalinos burbujeando en un océano ácido forman células catalíticas minerales «con un gradiente de protones a través de sus membranas inorgánicas», dice Russell. «Están establecidos en la misma forma peculiar que todas las células actuales».
Algunos investigadores han rechazado las «células» naturales quimiosmóticas de Russell como una mera curiosidad, irrelevante para el origen de la vida. Pero cuando Martin y Russell examinaron la bioenergética de los más simples procariotas, se dieron cuenta de que las primeras células nunca podrían haber escapado de los ventiladeros sin esa quimiosmosis natural, lo que explica por qué el extraño mecanismo de Mitchell es tan fundamental para la vida actual, y tan universal.
El gran escape
En toda la increíble riqueza de la vida en la Tierra sólo hay cinco maneras en que se captura el dióxido de carbono y se convierte en materia viva, y sólo uno de ellos no cuesta nada en absoluto. Es la reacción directa de hidrógeno con dióxido de carbono. Esta reacción exotérmica convierte el dióxido de carbono en moléculas orgánicas simples y también libera energía. Se ha descrito como «un almuerzo gratis donde te pagan por comer». Y si bien el hidrógeno no suele burbujear por sí solo desde la tierra, sí lo hace en los respiraderos alcalinos.
La reacción del hidrógeno con el dióxido de carbono es fundamental para la vida en los respiraderos, pero hay un gran problema: cuesta un poco de energía iniciar la reacción en un principio, mientras que la cantidad de energía necesaria para mantener el crecimiento es insignificante. De hecho, es tan insignificante, de acuerdo con Rolf Thauer en el Max Planck Institute for Terrestrial Microbiology en Marburg, Alemania, que es imposible que las bacterias crecieran sólo por la química: necesitan la energía de la quimiosmosis de protones.
Para entender esto, piense en la energía almacenada por el ATP como un equivalente a 10 dólares. Si toma 10 dólares para poner en marcha una reacción que luego libera 15, en teoría la célula ha ganado 5 dólares. Sin embargo, si la única forma que tiene una célula de almacenar energía es producir ATP, puede hacer sólo una molécula, ya que hacer dos nuevos ATPs costaría 20 dólares. Así que se ha gastado un ATP para obtener un ATP, y los 5 dólares de sobra se desperdiciaron como calor. Eso no es compatible con mantenerse vivo.
Para la proto-vida en los ventiladeros, esto no habría sido problema. El fluido de las chimeneas contenía moléculas reactivas como sulfuro de metilo, lo que generaría acetil fosfato, una molécula que algunas bacterias de hoy todavía usan de manera intercambiable con el ATP. Es más, el gradiente natural de protones complementó esta fuente de energía por generación espontánea de otra forma primitiva del ATP, llamado pirofosfato.
El pirofosfato también actúa de forma muy similar al ATP, y todavía es usado junto con el ATP por muchas bacterias y arqueas. Estas bacterias aceleran su producción utilizando una enzima simple llamada pirofosfatasa. En un trabajo que pronto se publicará realizado junto a Wolfgang Nitschke en el Instituto de Biología Estructural y Microbiología en Marsella, Francia, Russell ha demostrado que esta enzima se encuentra en algunas de las células más primitivas que conocemos y está a ambos lados de la división entre bacterias y arqueas. Lo que sugiere que data bien desde el principio.
Así que el ancestro común de la vida podría haber aprovechado el gradiente natural de protones de los respiraderos antiguos para producir energía. Para escapar de los ventiladeros, sólo era necesario un paso más: revertir el proceso para almacenar energía.
La quimiosmosis permite que las células ahorren pequeñas cantidades de energía, los 5 dólares que de otro modo se perderían. Una reacción que se puede repetir una y otra vez, sólo para bombear protones por una membrana. Es como ahorrar para comprar algo, eventualmente el gradiente de protones será suficiente para producir un pirofosfato o un ATP. El resultado es que los gradientes de protones permiten que las células crezcan, y puedan salir de los ventiladeros.
De hecho, parece que la rareza de Mitchell es una condición previa necesaria para la vida. Si bien la descomposición de azúcares puede proporcionar suficiente energía para crecer sin necesidad de quimiosmosis, el proceso —la glucólisis— involucra complejas vías y requiere montones de azúcar, por lo que es muy improbable que haya sido la fuente principal de energía para la vida inicial.
El cuadro pintado por Russell y Martin es en verdad impresionante. El ancestro común de la vida no era una célula viva independiente, sino una roca porosa llena de burbujas con membrana de sulfuro de hierro que catalizaron las reacciones bioquímicas primordiales con el impulso del hidrógeno y los gradientes de protones, este reactor de flujo natural lleno de productos químicos orgánicos, dando lugar a una proto-vida que finalmente surgió como las primeras células vivientes, no una vez sino dos, dando lugar a las bacterias y las arqueas.
Faltan llenar muchos detalles, y puede que nunca sea posible demostrar más allá de toda duda que la vida evolucionó por este mecanismo. La evidencia, sin embargo, está creciendo. Este escenario coincide con las propiedades conocidas de la vida en la Tierra, es energéticamente plausible, y pone de vuelta a la gran teoría de Mitchell en su legítimo lugar en el centro mismo de la biología.
Fuente: New Scientist. Aportado por Eduardo J. Carletti