|
10/Feb/07
 |

Revista Axxón
Axxón en
facebook

Lectores de Axxón en facebook


|
|
¿Es posible una vida diferente?
Químicos de Yale demuestran que la Naturaleza podría haber usado diferentes proteínas base.
De acuerdo con un informe anunciado en la web de la Journal of the American Chemical Society, los químicos de Yale han hecho lo que la Madre
Naturaleza eligió no hacer: una molécula similar a las proteínas, pero fuera de los ladrillos básicos naturales, .
La naturaleza usa bases de alfa-aminoácidos para ensamblar las proteínas que hacen que la vida sea posible tal y como la conocemos. Químicos de Yale han
informado de pruebas que indican que la naturaleza podría haber usado distintos ladrillos —beta-aminoácidos— y demuestra que los péptidos que se ensamblan a
partir de los beta-aminoácidos pueden acoplarse en estructuras de la misma forma que las proteínas naturales.
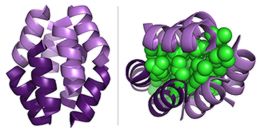
Haces-Beta: Representación en diagrama de lazo
de un haz beta-péptido ilustrando empaquetamiento entre
hélices (izquierda) y
núcleo(derecha) hidrofóbico (verde).
"La estructura de rayos-x caracterizada en el informe muestra una molécula que comparte muchas características estructurales con las proteínas naturales", dijo el
autor principal Alanna Schepartz, Profesor Ph.D. de Química en Yale y Profesor del Instituto Médico Howard Hughes. "Estudios relacionados demuestran que
las propiedades físicas de las moléculas son también notablemente similares a las proteínas naturales. En otras palabras, el ensamblaje de beta-péptidos parece y
actúa casi igual que una proteína real".
La capacidad de imitar proteínas naturales hace de los beta-péptidos una nueva y potente herramienta para la investigación básica y el descubrimiento de
medicinas. Como una cinta de grabación, su mayor valor puede estar en su diferencia respecto a la representación de la vida.
"Dado que los beta-péptidos no son procesados en la célula como péptidos naturales o proteínas, puede ser posible en el futuro, diseñar beta-péptidos que
mejoren el rendimiento, o en más localizaciones, de las actuales medicinas de proteínas", dijo Schepartz. "También pueden tener propiedades únicas como
biomateriales".
Las proteínas naturales están compuestas de cadenas lineales de alfa-aminoácidos. Los beta-péptidos están formados por beta-aminoácidos, los cuales tienen un
carbono extra en su cadena. Como los alfa-aminoácidos, los beta-aminoácidos son generados bajo condiciones prebióticas simuladas, son aislados de los
meteoritos, y son bioproductos del metabolismo, pero no están genéticamente codificados como las proteínas naturales, ni son construidos en cadenas por las
células.
Desde principios de los años 90, los científicos han sido capaces de ensamblar beta-péptidos en hélices aisladas. Hasta ahora, sin embargo, crear una estructura
que mimetice el gran tamaño y la compleja estructura replegada de una proteína natural había sido un objetivo muy esquivo. El equipo de Schepartz resolvió el
dilema diseñando una molécula que podía formar usando características encontradas en las proteínas naturales — un interior graso que repele el agua y un
exterior hidrófilo. Este artículo, que proporciona la primera imagen de alta resolución de tal estructura, muestra un haz de otro beta-péptidos.
"La estructura que vemos es intrigante, como si sugiriese que las proteínas naturales podrían haber sido compuestas por beta-aminoácidos, pero no hubiesen sido
elegidas para ello", dijo Schepartz.
Los coautores de este artículo son los profesores de post-doctorado Douglas S. Daniels y E. James Petersson, y el estudiante graduado Jade X. Qiu. La
investigación fue financiada por los Institutos Nacionales de Salud, la Fundación Nacional para la Investigación del Cáncer y el Centro Yale para la Biología
Estructural.
Fuente: Astroseti. Aportado por Eduardo J. Carletti
Más información:
Yale Chemists Show that Nature Could have Used Different Protein Building Blocks
|