13/May/09
 |

Revista Axxón
Axxón en
facebook

Lectores de Axxón en facebook


|
|
Bacterias verdes: un paso adelante para lograr la fotosíntesis artificial
Un equipo internacional ha determinado la estructura de la molécula de
clorofila de las bacterias verdes. Este resultado quizás
permita algún día recrear una fotosíntesis
artificial eficiente
Estos científicos han descubierto que las moléculas de clorofila de las
bacterias verdes son muy eficientes
captando energía luminosa. La razón parece ser la orientación de las propias moléculas.
 Una sección delgada de microfotografía electrónica (izquierda) de la bacteria Chlorobaculum tepidum que muestra
clorosomas (óvalos pálidos) cerca de la pared celular.
Microfotografías electrónicas de clorosomas aislados de la versión mutante (centro). Modelo molecular que muestra las moléculas de clorofila dentro del
clorosoma, moléculas de clorofila aparece en verde y muestran sus extremos hidrófobos apuntando hacia afuera (derecha). Fotos: Donald Bryant, Penn State
University, PNAS.
Una sección delgada de microfotografía electrónica (izquierda) de la bacteria Chlorobaculum tepidum que muestra
clorosomas (óvalos pálidos) cerca de la pared celular.
Microfotografías electrónicas de clorosomas aislados de la versión mutante (centro). Modelo molecular que muestra las moléculas de clorofila dentro del
clorosoma, moléculas de clorofila aparece en verde y muestran sus extremos hidrófobos apuntando hacia afuera (derecha). Fotos: Donald Bryant, Penn State
University, PNAS.
|
Las
bacterias verdes son un grupo de
organismos que viven generalmente en ambientes pobres en luz, como las regiones oscuras de fuentes hidrotermales a 100 metros de profundidad del mar
Negro. Estas bacterias contiene estructuras denominadas
clorosomas que contienen unas 250.000 moléculas de
clorofila.
Donald Bryant, de Penn State, recuerda que la habilidad de capturar la energía luminosa y suministrarla rápidamente en donde se necesite es esencial para estas
bacterias, algunas de las cuales sólo ven unos pocos fotones por molécula de clorofila al día.
Los clorosomas de estas bacterias son difíciles de estudiar, y han sido la última clase de complejos captadores de luz cuya estructura se ha caracterizado.
Saber la estructura de las proteínas (o en su tiempo la del
ADN) tampoco es sencillo. Para esta tarea se emplea
normalmente la cristalografía de rayos X.
| |
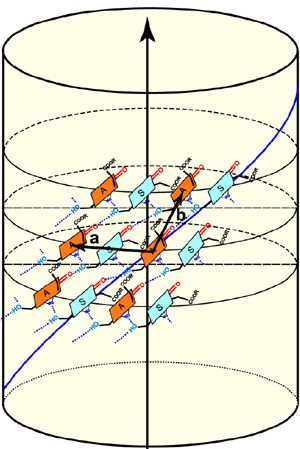 Disposición y estructura de las moléculas de clorofila (en verde y naranja) estudiadas, y que se disponen en forma de hélice. Foto: Donald
Bryant / PNAS.
Disposición y estructura de las moléculas de clorofila (en verde y naranja) estudiadas, y que se disponen en forma de hélice. Foto: Donald
Bryant / PNAS.
|
Un paso previo es conseguir que la molécula a estudiar cristalice de tal modo que muchas moléculas se dispongan de manera ordenada en una red cristalina. Por
tanto, esta técnica sólo funciona si las moléculas a estudiar son uniformes en tamaño, forma y estructura.
Cada clorosoma de las bacterias verdes tiene una organización única y por tanto la técnica de cristalografía de rayos X no se puede emplear para caracterizar
su estructura interna.
Para solucionar este escollo, los investigadores se valieron de varias técnicas. Una de ellas consistió en crear bacterias genéticamente modificadas que tuvieran
una estructura más homogénea. También emplearon la
microscopía lectrónica
y resonancia magnética nuclear
. Todo esto les permitió saber incluso la estructura de los componentes de los clorosomas y tener un modelo completo de los mismos.
La ingeniería genética que practicaron es interesante, porque para la creación del mutante tuvieron que desactivar tres genes que se adquirieron recientemente
desde el punto de vista evolutivo. Los investigadores sospechaban que precisamente estos genes son los que proporcionan a las bacterias su mayor capacidad
de captar la energía luminosa, por lo que esta ingeniería genética era como ir hacia atrás en el tiempo.
Para poder tomar las imágenes de microscopía electrónica hubo que enfriar las muestras hasta llegar a temperaturas criogénicas. Así pudieron ver que las
moléculas de clorofila que hay dentro de los clorosomas tienen forma de nanotubo a la manera de muñecas rusas, con un tubo concéntrico dentro de otro. Las
bacterias mutantes sólo contenían un conjunto de estos tubos mientras que las normales contenían varios, cada uno dispuesto en un patrón único.
Finalmente la resonancia magnética nuclear (RMN) reveló que las moléculas de clorofila venían dadas en forma de dímeros (parejas de dos moléculas idénticas)
con sus colas hidrófobas unidas. Descubrieron
además que las moléculas de clorofila de estos clorosomas se disponen en forma de hélice (de manera similar al ADN). En las bacterias mutantes estas moléculas
se disponen en un ángulo de 90 grados en relación al eje del nanotubo siendo este ángulo menor en las bacterias naturales.
Lo importante parecer ser precisamente la orientación de las moléculas de clorofila, pues les permite recoger mayor energía luminosa. Todo esto fue posible a la
capacidad de la RMN de situar espacialmente y con precisión los núcleos atómicos.
Parece contraintuitivo que las bacterias verdes hayan evolucionado para captar más energía solar desordenando las estructuras del clorosoma. Según Bryant la
gente podría pensar que una estructura más ordenada funcionaría mejor, pero en este caso claramente no es verdad. Si todas las moléculas de clorofila fueran
idénticas y estuvieran dispuestas de manera perfecta dentro del clorosoma, la energía de un fotón incidente, una vez absorbida, estaría dando vueltas por el
sistema demasiado tiempo. En la versión natural la movilidad de esta energía se restringe y la energía de un fotón individual visita un número pequeño de
moléculas. De este modo se incrementa la capacidad de obtener energía allí donde se necesita.
La clave está en la velocidad. Los microorganismos tienen sólo un par de nanosegundos para utilizar en algún lugar la energía captada antes de que ésta se
pierda. Y este problema de la velocidad puede ser grave para microorganismos como estas bacterias, que viven en lugares con poca luz y que sólo reciben unos
pocos fotones diarios por molécula de clorofila.
Bryant dice que este resultado quizás sea útil un día si se consigue desarrollar un sistema de fotosíntesis artificial que produzca electricidad a partir de la energía
solar. La idea sería crear estructuras específicas con moléculas de clorofila o análogas en disolución acuosa para así optimizar la capacidad de absorber energía
luminosa.
Una planta de cultivo normal sólo transforma en azúcares un porcentaje muy pequeño de la energía solar recibida, de ahí que, a priori, el uso de biocombustibles
no sea tan buena idea como parece en una primera aproximación. Puede que sea mejor utilizar otro tipo de seres fotosintéticos. Recientemente se han
producido, por ejemplo, avances con algas unicelulares en este sentido. Quizás este hallazgo también pueda ser utilizado para la producción de
biocombustibles eficientes a través de una ingeniería
genética que permita crear organismos más apropiados para su producción.
Fuente: Neofronteras. Aportado por Gustavo A. Courault
Más información:
Más noticias de Ciencia en Axxón
Avanza un paso la fotosíntesis artificial
Estudian bacteria marina que obtiene energía de la luz sin hacer fotosíntesis
Mejoran el diseño de vegetales en un modelo informático