La investigación puede apuntar a objetivos terapéuticos más eficaces para las enfermedades mortales por priones
 Científicos del Instituto Scripps de Investigación han determinado por primera vez que los priones, fragmentos de proteína infecciosa desprovista de ADN o ARN que pueden causar enfermedades neurodegenerativas fatales, tienen capacidad de evolución darwiniana.
Científicos del Instituto Scripps de Investigación han determinado por primera vez que los priones, fragmentos de proteína infecciosa desprovista de ADN o ARN que pueden causar enfermedades neurodegenerativas fatales, tienen capacidad de evolución darwiniana.
El estudio de Scripps Florida en Jupiter, EEUU, muestra que los priones pueden desarrollar una gran cantidad de mutaciones a nivel de proteína y, por medio de la selección natural, estas mutaciones pueden producir adaptaciones evolutivas como la resistencia a las drogas, un fenómeno que se conocía antes sólo en las bacterias y los virus. Estos hallazgos también indican que la proteína normal de prión —que se produce naturalmente en las células humanas— puede llegar a ser un objetivo terapéutico más eficaz que su relación tóxica anormal.
El estudio se publicó en el 31 de diciembre de 2009 en la revista Science Express, una edición previa en línea de la prestigiosa revista Science.
«En vista de ello, se tiene exactamente el mismo proceso de mutación y cambio adaptativo en los priones que se ve en los virus», dijo Charles Weissmann, MD, Ph.D., director del Departamento de Scripps Florida de Infectología, que dirigió el estudio. «Esto significa que este patrón de evolución darwiniana parece ser universalmente activa. En los virus, la mutación está relacionada con cambios en la secuencia de ácidos nucleicos que conduce a la resistencia. Ahora esta adaptación se ha corrido un nivel hacia abajo —hacia los priones y el plegamiento de las proteínas— y está claro que no se necesita ácido nucleico para el proceso de evolución».
Los priones (abreviatura de partículas proteicas infecciosas) infecciosos están asociados con alrededor de 20 diferentes enfermedades en los seres humanos y animales, incluyendo la enfermedad de las vacas locas y una forma humana rara, la enfermedad de Creutzfeldt-Jakob. Todas estas enfermedades son intratables y eventualmente fatales. Los priones, que están compuestos exclusivamente de proteínas, están clasificados en cepas diferentes, que originalmente se caracterizan por su tiempo de incubación y la enfermedad que causan. Los priones tienen la capacidad de reproducirse, a pesar de que no contienen un genoma de ácido nucleico.
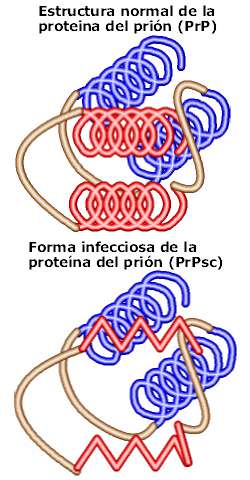
Las células de mamíferos normalmente producen la proteína priónica celular o PrPC. Durante la infección, una proteína anormal o mal plegada —conocida como PrPSc— convierte la proteína normal del prión hospedador en su forma tóxica, cambiando su conformación o forma. La fase final consiste en grandes ensambles (polímeros) de estas proteínas mal plegadas, que causan daño masivo a los tejidos y células.
«En general se pensaba que una vez que la proteína priónica celular se convertía en la forma anormal, no había ningún cambio más», dijo Weissmann. «Pero hubo indicios de que algo estaba pasando. Al transmitir priones de ovejas a los ratones, se hacen más virulentos con el tiempo. Ahora sabemos que los priones anormales se replican y crear variantes, quizás en un nivel bajo al principio. Pero una vez que se transfieren a un nuevo huésped, la selección natural eventualmente escoge las variantes más virulentas y agresivas».
Resistencia a las drogas
En la primera parte del estudio, Weissmann y sus colegas transfirieron poblaciones de priones de células de cerebro infectadas a células de cultivo. Al ser trasplantados, los priones adaptados a las células se desarrollaron y compitieron con sus homólogos adaptados al cerebro, lo que confirma la capacidad de los priones para adaptarse al nuevo entorno, un sello distintivo de la evolución darwiniana. Cuando regresaron al cerebro, los priones adaptados al cerebro de nuevo se hicieron cargo de la población.
Para confirmar los resultados y estudiar la cuestión de la evolución de la resistencia a los medicamentos, Weissmann y sus colegas utilizaron la droga swainsonina o SWA, que se encuentra en plantas y hongos, y que se ha demostrado que inhibe ciertas cepas de priones. En los cultivos donde estaba presente la droga, el equipo descubrió que la sub-cepa de priones resistentes a la droga evolucionaron hasta convertirse en predominantes. Cuando se retiró la droga, la sub-cepa susceptible a la swainsonina volvió a crecer para convertirse en el principal componente de la población.
Weissmann observa que los resultados tienen implicaciones para el desarrollo de dianas terapéuticas para las enfermedades de los priones. En lugar de desarrollar drogas para apuntar a las proteínas anormales, podría ser más eficiente tratar de limitar el suministro de los priones producidos normalmente, en esencia, reducir la cantidad de combustible que alimenta el fuego. Weissmann y sus colegas han demostrado hace unos 15 años que ratones modificados genéticamente carentes de la proteína normal de prión se desarrollan y funcionan de manera completamente normal (¡y son resistentes a las enfermedades priónicas!).
«Es probable que sea muy difícil inhibir farmacológicamente la producción de una proteína natural específica», dijo Weissmann, «Se puede terminar por interferir con otros procesos fisiológicos críticos, pero no obstante, encontrar una manera de inhibir la producción de la proteína normal del prión es un proyecto que actualmente persigo en colaboración con la profesora Corinne Lasmezas de Scripps Florida en nuestro departamento».
Cuasi-especies
Otra consecuencia de los resultados, según el estudio, es que las variantes resistentes a drogas o bien existen en la población de priones en un nivel bajo antes de la exposición o se generan durante la exposición a la droga. De hecho, los investigadores encontraron que algunos de los priones secretados por las células infectadas resultaban resistentes a la droga antes de la exposición, pero sólo en niveles inferiores al uno por ciento.
Los científicos muestran que las variantes del prión surgen de forma constante en una población en particular. Se cree que estas variantes o «mutantes» difieren en la forma en que se pliega la proteína del prión. Como consecuencia, las poblaciones de priones son, de hecho, compuestas de múltiples sub-cepas.
Esto, señaló Weissmann, es una reminiscencia de algo que él ayudó a definir hace unos 30 años, el concepto evolutivo de los cuasi-especie. La idea fue concebida por Manfred Eigen, un biofísico alemán, que ganó el Premio Nobel de Química en 1967.
Dicho básicamente, una cuasi-especie es una población compleja, que se perpetúa a sí misma, de diversas entidades relacionadas y que actúan como un todo.
Fue Weissmann, sin embargo, quien aportó la primera confirmación de la teoría a través del estudio de un bacteriófago en particular —un virus que infecta bacterias— mientras era director del Institut für Molekularbiologie en Zúrich, Suiza.
«La prueba del concepto de cuasi-especie es un descubrimiento que hicimos hace 30 años», dijo. «Encontramos que la población de ARN del virus, del que se pensaba que había sólo una secuencia, estaba creando constantemente mutaciones y eliminando las desfavorables. En estas cuasi- poblaciones, al igual que hemos encontrado en los priones, se comienza con una sola partícula, pero se hace muy heterogénea cuando se convierte en una población mayor»
Hay alguna dinámica desconocida actuando en la población del prión que conduce a esta creciente heterogeneidad, agregó Weissmann, que todavía debe ser explorada.
«Es sorprendente que algo que hicimos hace 30 años haya vuelto a nosotros», dijo. «Pero sabemos que la mutación y la selección natural se producen en los organismos vivos y ahora sabemos que también se producen en un organismo no vivo. Supongo que si no lo pudiera hacer no serían muy grandes sus posibilidades de sobrevivir».
Fuente: EurekAlert. Aportado por Eduardo J. Carletti
Más información: