







El 6 de marzo de 1869, se celebró una conferencia en la Sociedad Química Rusa.
La reunión no trascendió demasiado, tal vez por el críptico título que llevaba: "La dependencia entre las propiedades de los pesos atómicos de los elementos". La charla fue transcripta en un periódico ruso casi desconocido, pero pronto fue levantada y reproducida por la prestigiosa revista alemana Zeitschift für Chemie ("Revista Química"), a partir de donde ganó visibilidad mundial.
Así, un hecho científico que al principio había pasado inadvertido, se convirtió en lo que realmente siempre había sido: un axioma destinado a cambiar la historia de la ciencia.
El 8 de febrero (27 de enero según el calendario juliano) de 1834, nació Dimitri Ivanovich Mendeleiev en la aldea de Tobolsk, Rusia. Era el decimoséptimo hijo del próspero matrimonio formado por Iván Pavlovich Mendeliev y María Dimitrievna Kornilieva.
El pequeño Dimitri estudió primero teología, pero, al llegar a los 13 años, la muerte de su padre y el inesperado incendio de los negocios de su madre precipitó a la familia en la pobreza, que debió mudarse a San Petersrburgo. Allí, la nueva escuela despertó la pasión del jovencito por la química, ciencia que comenzó a estudiar con gran interés, a tal punto que a los 23 años de edad ya había sido nombrado Jefe del área de Ciencias del Colegio N° 1 de Simferopol, adonde se había trasladado por razones de salud.
De nuevo en San Petersburgo, Mendeleiev comenzó a estudiar la capilaridad de los líquidos, lo que le valió que se le permitiera trabajar con los primeros espectrógrafos en la Universidad de Heidelberg entre 1859 y 1861.
A la edad de 33, obtuvo el cargo de profesor vitalicio en la gran capital rusa, y en brevísimo tiempo la convirtió en La Meca de la investigación química mundial. Muy interesado en las bebidas alcohólicas, su disertación "Sobre las combinaciones de agua y alcohol" se convirtió en su tesis de grado, mediante la cual obtuvo el título de Doctor en Ciencias en 1865. En 1869 fundó, junto a otros, la Sociedad Química Rusa.

Dimitri Ivanovich Mendeleiev
Dimitri Mendeleiev dedicó toda su vida a la investigación: desde descubrir la composición geológica de los campos petrolíferos (y fundar la primera refinería de petróleo rusa) hasta producir una fórmula de la expansión de los gases independientemente de Gay-Lussac. Descubrió en 1861 (es decir, antes de su descubrimiento "oficial") el concepto de temperatura crítica de los gases, introdujo el Sistema Métrico Decimal en Rusia e inventó el pirocolodión, una pólvora sin humo basada en la nitrocelulosa. Ofreció el explosivo a la Armada Rusa, que no lo quiso, por lo que se las arregló para comenzarlo a producir él mismo. No conforme con lo dicho, Mendeleiev se sumergió profundamente en la agricultura y en la teoría y práctica de la protección del comercio.
Obtuvo premios y condecoraciones de prácticamente todas las sociedades y organizaciones científicas de Europa, como por ejemplo la Medalla Copley de la Royal Society de Londres.
Tras tantos e incontables logros, Dimitri Ivanovich Mendeleiev murió de gripe en San Petersburgo en 1907, seis días antes de cumplir 73 años de edad.

Mendeleiev en 1904, trabajando en su estudio
Dijo de él el químico e historiador de la ciencia ruso L.A. Tchugaiev: "Fue un químico genial, físico de primer nivel, productivo investigador en los campos de la meteorología, la hidrodinámica, la geología, ciertas ramas de la tecnología química (explosivos, petróleo y combustibles, por ejemplo) y otras disciplinas adyacentes a la química y la física, un experto completo en la industria en general y la industria química en particular, y un original pensador en el área de la economía".
Muchos homenajes ha recibido Mendeleiev desde su muerte: podemos citar como ejemplo el cráter lunar Mendeleiev y el elemento de peso atómico 101 —radioactivo—: el mendelevio.
Pero muchos de nosotros deberíamos homenajearlo, además, por otro tipo de
estudios: en 1893, Mendeleiev fue nombrado director del Departamento de Pesos y Medidas ruso, donde debió ocuparse de la composición de los alimentos y de sus estándares de producción y de calidad.
En esta tarea, su amor por los pesos moleculares lo llevó a estudiar minuciosamente la composición del vodka, hasta llegar a la conclusión de que un vodka en perfecto equilibrio molecular (el vodka perfecto, vamos), debía tener cada una de sus moléculas de alcohol diluída por exactamente dos moléculas de agua. Esto da un volumen de dilución de 38% de alcohol en 62% de agua. O sea: vodka de 40°, la forma moderna que todos conocemos y disfrutamos hoy.
Sorprendido y encantado por la perfección química, formal y gustativa de su trabajo, el gobierno ruso promulgó en 1894 la nueva Ley del Vodka, que obliga, desde entonces, a que toda bebida espirituosa que pretenda el derecho a ser rotulada "vodka" debe tener la composición molecular exacta descripta por Mendeleiev en su trabajo.
Tal hombre sería quien daría, en 1869, la conferencia sobre los pesos atómicos con la que abrimos el presente artículo.
Ciertos elementos químicos como el oro, el hierro, el cobre o el plomo han sido conocidos por el hombre desde la noche de los tiempos, porque suelen presentarse en forma nativa, meteórica, o bien en afloramientos superficiales relativamente fáciles de explotar con herramientas primitivas.
Los otros, aquellos que se encuentran asociados químicamente con otros o en situaciones de dificultosa exploración, tuvieron que esperar mucho más. Imagínese que para el hombre primitivo fue muy fácil identificar y aprender a trabajar el hierro, que caía desde el cielo en estado químicamente puro mediante los meteoritos, pero imposible separar el cloro y el sodio, que en su inmensa mayoría se encuentran en la Tierra combinados bajo la forma de sal común.

Monumento a Mendeleiev y la tabla periódica
Más tiempo aún tuvieron que esperar los elementos radioactivos sintéticos de alto peso molecular: concretamente, hasta los siglos XX y XXI.
El primer elemento químico cuyo descubridor se encuentra históricamente registrado fue el fósforo. Ocurrió en 1649, cuando el alemán Hening Brand procuraba destilar orina humana para obtener la famosa Piedra Filosofal. Esta era una sustancia que, en teoría, era capaz de transmutar metales viles en oro, medio por el que Brand planeaba escapar de la miseria a la que le había conducido la quiebra de su empresa comercial. Brand mantuvo su descubrimiento en secreto, pero, a su vez, Robert Boyle lo descubrió independientemente 31 años después y, como no era un mercader en bancarrota sino un químico, lo publicó de inmediato.
A partir de allí, los descubrimientos de nuevos elementos químicos se sucedieron con frecuencia, y, a medida que crecía la lista, los esfuerzos de los científicos por comenzar a clasificarlos se hicieron más y más denodados. Ya no alcanzaba con saber que algunos eran metálicos y otros no metálicos, ni que los había sólidos, líquidos y gaseosos. Se necesitaba una clasificación verdaderamente sistemática.
El primero en intentarlo concienzudamente fue el químico francés Antoine-Laurent de Lavoisier. En su Traité Élémentaire de Chimie(«~Tratado Elemental de Química~»), daba la lista de los elementos conocidos hasta el momento, como por ejemplo el zinc, el mercurio, el oxígeno y el nitrógeno, mostrando incluso la luz y el calor, a los que Lavoisier creyó sustancias materiales. A pesar de este error, el libro de Lavoisier estaba muy bien escrito y era sistemático, y como consecuencia de ello fue tomado por las generaciones sucesivas como base de las listas de elementos actuales. Sin embargo, la única clasificación que incluía era la de metales versus no metales.
Alexandre-Emile Béguyer de Chancourtois siguió a Lavoisier en el intento de clasificación sistemática de los elementos químicos. Alrededor de 1862, se tomó el trabajo de ordenarlos de menor a mayor por sus pesos atómicos, y observó con sorpresa que los elementos con propiedades similares aparecían a intervalos regulares en la lista. Curiosamente, Chancourtois escribió los elementos ordenados sobre la superficie de un cilindro. La lista seguía la forma de una espiral, y pudo así observar sin sorpresa que, una vez completa, los elementos de características similares quedaban alineados verticalmente. Chancourtois llamó a esta disposición "hélice telúrica", sin darse cuenta de que acababa de construir una versión primitiva de la tabla periódica. Pero el informe de Chancourtois fue publicado en jerga técnica geológica, por lo que no fue leído ni estudiado por los químicos.

La Hélice Telúrica
En 1856, el químico inglés John Newlands ordenó una vez más los elementos químicos conocidos hasta el momento —la lista ya sumaba 56—, organizándolos en 11 grupos según sus porpiedades físicas. Newlands observó que la periodicidad a la que aludía la hélice de Chancourtois se daba, en efecto, entre elementos de características similares, y que la distancia o separación entre dos de ellos siempre era de 8 o un múltiplo de 8. Entonces llamó a este descubrimiento "Ley de las Octavas" (por analogía con la música), pero nadie lo tomó en serio. El hallazgo de Newlands tuvo que esperar a los descubrimientos de la valencia (1916) y del papel de los octetos electrónicos en las uniones químicas (1919) para que se le reconociera su calidad de pionero.
Es evidente que Mendeleiev pasó mucho tiempo estudiando los descubrimientos de sus predecesores. Durante un largo viaje en tren, jugó durante horas con un mazo de barajas que tenían impresas las características de cada elemento químico de los 64 conocidos en ese momento. Procedió así a una especie de increíble "solitario", en que las organizó sobre la mesa de una forma muy particular, nunca lograda hasta ese momento. Los elementos estaban ordenados de izquierda a derecha y de arriba abajo por su peso atómico, y en ella se observaba que los "períodos" quedaban alineados en forma vertical y diagonal. Aparte del ordenamiento, la novedad del sistema de Mendeleiev es que las columnas y diagonales no tenían todas la misma longitud, porque el ruso observó que las propiedades variaban gradualmente conforme se adentraban en la tabla. Sobre estos hechos versó su conferencia de 1869, que se puede resumir en pocas palabras: "Las propiedades de los elementos son funciones periódicasde sus pesos atómicos".

Célebre retrato de Mendeleiev
Como consecuencia, los elementos cuyas propiedades químicas se asemejan tienen pesos atómicos similares (por ejemplo el osmio y el iridio) o bien presentan una regularidad en el incremento del mismo, como en el caso del níquel, el paladio y el platino, cuya regla de incremento es 4 (entre Ni y Pd), 32 (entre Pd y Pt) y la próxima sería nuevamente 32 (darmstadtio). Todos ellos quedan, por ende, ubicados en la misma columna vertical. Obsérvese que el incremento es múltiplo de 8.
Además, la tabla periódica de Mendeleiev muestra la clara correspondencia entre la ubicación de un grupo y su valencia, y que los elementos de bajo peso atómico son, por lejos, los más abundantes en el universo. Así como el tamaño de una molécula determina las características de un compuesto, asimismo el tamaño de un átomo (su peso atómico) determina sus características.
Tal vez uno de los rasgos más importantes del trabajo de Mendeleiev es el hecho de que a partir de los elementos conocidos, puede predecirse con total certezael descubrimiento de otros nuevos, y deducir sus propiedades.
Así, se supo que debía existir un elemento similar al indio, cuyo número atómico debía ser 81 (porque el indio tiene 49, y 49 + 32 = 81). El elemento por supuesto que existe: es el talio. Antes de su descubrimiento, ya se sabía incluso qué peso atómico podía tener, porque la tabla también permite predecir el mismo en base a los de los dos contiguos. La masa del talio debía ser de entre 200 (el mercurio, que está a su izquierda) y 207 (el plomo, a su derecha), pero no 198 o 215, por ejemplo. Por supuesto, al descubrirse el talio, se observó que su masa era de 204 tal cual la tabla mendeleiana predecía.

La Medalla Mendeleiev, máximo galardón otorgado
por la Sociedad Química Rusa
Esta "infalibilidad" de la tabla de Mendeleiev dio un vuelco a la ciencia química como nunca nadie había sido capaz de darle.
Durante lo que restaba del siglo XIX, todo el siglo XX y los que va del XXI, los descubrimientos de elementos nuevos se sucedieron, siempre respetando los parámetros antedichos. Así, en 1875 se descubrió el galio (predicho por Mendeleiev: dijo que debía ser similar al aluminio y lo bautizó "ekaaluminio", es decir, "parecido al aluminio"); en 1879 el escandio (llamado por el siberiano "ekaboro"); en 1886 el germanio ("ekasilicio"); en 1925 el renio (último elemento estable descubierto); en 1937 el tecnecio (primer elemento sintético, predicho por Mendeleiev bajo el nombre de "ekamanganeso"); en 1940 el neptunio (primer elemento transuránico); y así hasta la actualidad, donde tenemos una serie completa hasta el 118 (con la excepción del 117, que todavía no ha sido hallado, y algunos reclamos por parte de científicos israelíes, aún no confirmados, de haber hallado trazas del 122).
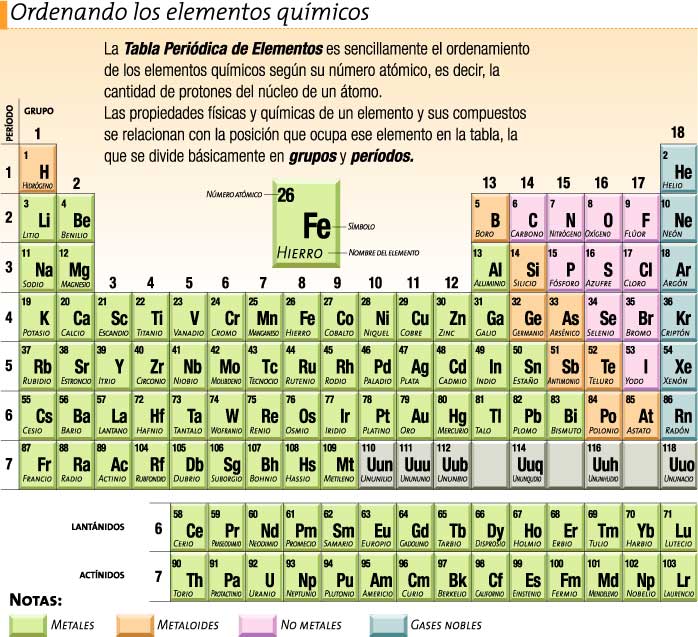
La tabla periódica
El elemento de mayor peso atómico que se halla en la naturaleza es el uranio (92). Todos los demás han sido obtenidos por síntesis en el laboratorio.
Huelga decir que cada uno de ellos ostenta todas las características que le corresponden de acuerdo a su posición en la tabla de Mendeleiev.
Pero... Siempre hay un pero en la historia de la ciencia, y este asunto no iba a ser la excepción.
Las características de las reacciones químicas de un elemento dependen de la estructura de su última capa orbital, es decir, de la cantidad de electrones que posea en la órbita más lejana. Esta es la verdadera razón del ordenamiento periódico: elementos con la misma disposición electrónica en la más externa de sus órbitas estarán en la misma columna de la tabla. Nunca hubo excepciones a esta norma. Al menos, no debería haberlas.
En diciembre de 1998, científicos del Instituto Unido de Investigación Nuclear de Dubna, Rusia, bombardearon átomos de 244Pu (plutonio-244) con iones de calcio-48. Al chocar un átomo de 48Ca con uno de 244Pu se creó un único átomo del elemento 114, que tuvo una vida media de 30 segundos. Se había descubierto un nuevo elemento, el 289114.
Cuatro meses después, los investigadores rusos se dispusieron a encontrar nuevos isótopos. En esa oportunidad obtuvieron dos átomos, bombardeando 242Pu en lugar de 244Pu. Se los llamó 287114 y 287m114, este último un isómero metaestable del anterior.
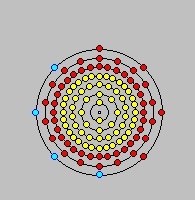
Capas electrónicas del 114
El elemento recién descubierto recibió el nombre provisorio de Ununquadium ("Uno-uno-cuatro" en latín) y el símbolo Uuq. Mendeleiev lo hubiese bautizado eka-plomo, porque se encuentra debajo de él en la tabla periódica, al final del período 6, que se inicia con el carbono y sigue con el silicio, el germanio y el estaño. Como el nombre ununqadium es tan difícil de pronunciar, normalmente se lo llama simplemente "elemento 114", "E114" o "114" a secas.
Como hemos venido explicando a lo largo de este artículo, cabría esperar que el E114 tuviese propiedades muy similares a las del plomo, siendo la mayor diferencia la radiactividad de aquel. Igualmente, tendría que haber otras: es obvio que los elementos de una misma columna son similares, aunque presentan diferencias más o menos acusadas. Estas se deben a que la cantidad de protones en el núcleo difiere de un elemento a otro. Como es lógico, un elemento con más protones atraerá a sus electrones con mayor fuerza, y por lo tanto estos últimos girarán más rápido. Al girar más rápido, la Teoría Especial de la Relatividad predice que el tiempo se dilatará para el electrón en cuestión, y su órbita será más estrecha y ajustada. Todos estos efectos se reflejan en las propiedades químicas del elemento, y han sido suficientemente observadas en el elemento 105 (dubnio, precisamente por el Instituto Unido de Dubna) y en materiales tan comunes como el oro metálico.
Las diferencias pueden ser bastante grandes, pero nunca lo suficiente como para comprometer la estadía del elemento en el lugar de la tabla que le corresponde.
Había que investigar al 114 para descubrir sus propiedades. Fue por ello que el químico Heinz Gäggeler, del Instituto Paul Scherrer de Villigen, Suiza, creó núcleos de 114 en el acelerador de partículas de Dubna. Bombardearon núcleos de plutonio con núcleos de calcio, y así lograron producir algunas docenas de núcleos de 114 por mes. Recluyeron estos núcleos en un contenedor sellado y lleno de argón. Los núcleos capturaron electrones del gas, y se convirtieron en átomos de 114 completos, neutros y estables.
Ahora los científicos tenían material para estudiar la química del recién llegado. Dispusieron un largo tubo con la luz interna forrada de oro, que presentaba una pendiente térmica: de 30°C en un extremo hasta - 185° en el otro, y bombearon el argón a través del mismo. Un átomo de plomo, por ejemplo, se hubiera combinado con el oro al principio del recorrido, mientras que un átomo de un gas raro —que no suele combinarse con nada—, hubiera hecho el trayecto casi completo, para adherirse al extremo más lejano, pero solo por el frío congelante, no porque se hubiese unido químicamente al tubo.
Quedasen donde quedaran los átomos de 114, se desintegrarían en escasos segundos, liberando un destello de rayos alfa. Vigilando donde se producían estos, los investigadores siempre podrían saber hasta qué distancia llegarían los átomos de 114.
Si el 114 era un metal similar al plomo, era esperable que la mayor parte de los destellos se produjeran al principio del tubo. Al fin y al cabo, tenía que ser un metal, dada su posición en la tabla periódica...
Vana esperanza: Gäggeler y los suyos obtuvieron algunos destellos al final, pero ninguno al principio... sin importar cuántas veces repitiesen el experimento. ¡El 114, un metal, se comporta como un gas noble similar al radón! Si se mira la tabla, el radón se encuentra entre los gases raros, cuatro columnas a la derecha del plomo. Y al observar los diagramas de las capas electrónicas del 114, se observa que en la más externa le faltan 4 electrones, mientras que un gas noble la tiene que tener completa (por eso no se combina con nadie).
¿Cómo se explica esto?
Nadie tiene la respuesta. Jamás un elemento ha probado ser de una naturaleza diferente a la que le predice Mendeleiev. Nunca en la vida un elemento ha intentado escapar de los límites que le impone la tabla periódica.
Si los resultados de Gäggeler se confirman, hay un gas noble infiltrado entre los metales, cuatro columnas a la izquierda de la que le corresponde. Un no metal en el lugar de un metal, y un gas donde debería haber un sólido. La periodicidad inexorable de la tabla podrá ser puesta en duda.
¿Pueden los efectos relativistas sobre los electrones producir una discordancia de tal calibre? Los científicos piensan que sí, pero solo a partir de los elementos 160 o 170, muy por encima de nuestra capacidad tecnológica actual de producirlos. Recién ahí Einstein comenzaría a dominar a Mendeleiev.
Con los datos actuales, la presencia del 114 entre los metales es inexplicable. Su número atómico no es lo suficientemente alto. Pero, con más datos e investigaciones más profundas, acaso los científicos puedan comprender el porqué del extraño comportamiento de un metal que no es sólido y que se conduce como un gas raro, descubriendo así el enorme secreto que oculta de nosotros el elemento rebelde, el extraño ununqadium.



