Científicos del Laboratorio Europeo de Biología Molecular identificaron un sistema de respuesta rápida que controla y rápidamente responde a los daños en el ADN
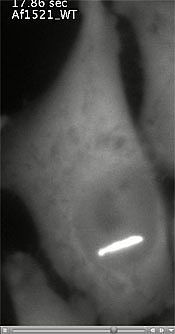 Clic en la imagen para ver la película Clic en la imagen para ver la película |
Nuestro genoma está constantemente bajo ataque por cosas como la luz ultravioleta y las toxinas, que pueden dañar o incluso romper las cadenas de ADN y, en última instancia conducir al cáncer y otras enfermedades. Los científicos saben desde hace mucho tiempo que cuando se daña el ADN, una enzima clave pone en marcha una «alarma» celular para alertar a la célula que debe iniciar el proceso de reparación, pero hasta hace poco no se sabía mucho acerca de cómo la célula detecta y responde a esta alarma.
En un estudio publicado ayer en Nature Structural and Molecular Biology, los investigadores del Laboratorio Europeo de Biología Molecular (EMBL) en Heidelberg, Alemania, han identificado una familia de proteínas capaces de una respuesta directa a la señal de alarma.
Nuestro genoma es un gran repositorio de información que orienta la construcción y función de todas las células en nuestros cuerpos.
Las células sufren muchos toques a su ADN todos los días, lo que puede conducir a mutaciones, de modo que mantienen una flota de maquinaria de reparación del ADN, que puede ser movilizada rápidamente y enviada a los sitios dañados en caso de emergencia.
Debido a que nuestro ADN es tan extenso y difícil de manejar, debe estar envuelto con proteínas y organizado en una compleja estructura denominada cromatina. Los científicos saben desde desde hace 50 años que uno de los componentes de la cromatina, una enzima conocida como PARP1, es activada por el daño del ADN y produce una señal molecular, denominada PAR, que da la alarma en el lugar de los daños.
En las últimas semanas, los científicos han trabajado por primera para saber cómo PAR es detectado rápidamente por la célula. En su artículo Nature Structural and Molecular Biology, el grupo de Andreas Ladurner y sus colegas en el EMBL han identificado a toda una familia de proteínas que responden a esta señal por la enlazándose a ella directamente.
¿Qué cuota de estes intercambio de proteínas forman una región especial llamada macrodominio? Mediante el uso de un láser para producir daños del ADN en el laboratorio, los científicos fueron capaces de seguir en las células unas proteínas de macrodominio marcadas con fluorescencia y observaron que se mueven rápidamente hacia el sitio de daño del ADN. Una imagen de alta resolución, obtenida por cristalografía de rayos X, muestra cómo el macrodominio forma un «bolsillo» que se adapta exactamente a las señales PAR.
Entre los miembros de la familia, los investigadores descubrieron una proteína llamada histona macroH2A1.1.
«Fue muy sorprendente. Las histonas juegan un papel importante en el montaje de la cromatina, y en mantenerla unida, pero no suelen tener macrodominios», dice Ladurner. «El hallazgo es particularmente relevante, porque resulta que las células cancerosas no tienen macroH2A1.1. El hecho de que un miembro del equipo de respuesta rápida que detecta el daño del ADN esté faltando podría contribuir a la enfermedad».
Debido a que MacroH2A1.1 está embebida en cromatina, cuando reconoce a la señal PAR en los sitios con daño del ADN, arrastra la compleja pero muy organizada maraña de cromatina con ella. Como resultado de ello, macroH2A1.1 condensa el ambiente de cromatina alrededor de la zona dañada.
Los científicos están ahora tratando de comprender por qué ocurre esto. Una explicación plausible sería que al compactar temporalmente al ADN, los extremos rotos de la molécula de ADN se mantienen más cerca. Esto debería aumentar las posibilidades de repararlo.
«Con estos hallazgos, hemos abierto perspectivas completamente nuevas en un campo de cincuenta años de investigación», dice Ladurner. «Estamos muy excitados por lo que está por venir y espero que pronto estaremos mucho más cerca de comprender cómo los macrodominios, junto con PARP1, mantienen un saludable genoma».
Fuente: European Molecular Biology Laboratory. Aportado por Eduardo J. Carletti