La senescencia celular es un proceso crucial en el desarrollo del embrión. Dos estudios publicados esta semana en la revista Cell describen la senescencia como un proceso normal durante el desarrollo embrionario. Ambos estudios atribuyen un rol completamente nuevo e inesperado a este proceso, a menudo relacionado con el envejecimiento y el cáncer
La senescencia es un estado en que las células limitan su proliferación en respuesta al estrés. Este estado celular se ha asociado históricamente a envejecimiento y a diversas patologías.
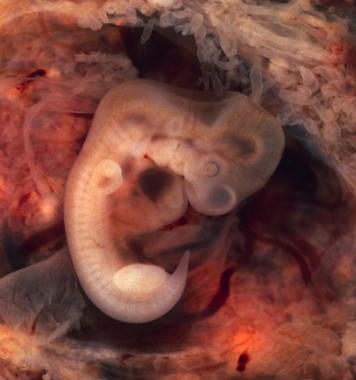
Ahora, investigadores del Centro de Regulación Genómica (CRG) en Barcelona y del Centro Nacional de Investigaciones Oncológicas (CNIO) en Madrid han descrito por primera vez que este estado no está relacionado exclusivamente con la proliferación de tumores o el estrés, sino que es algo absolutamente necesario durante el desarrollo embrionario.
“Por primera vez se demuestra claramente que la senescencia es un mecanismo programado en el desarrollo. Esta nueva descripción nos ayudará a comprender su papel e importancia como un proceso normal en la célula”, subraya Bill Keyes, jefe del laboratorio de Mecanismos de Cáncer y Envejecimiento del CRG.
“Nuestro trabajo demuestra que en el embrión, las células senescentes son necesarias y, mediante su habitual función secretora, dirigen el crecimiento y el patrón de los tejidos”, añade Keyes.
Su equipo ha descrito la senescencia como una parte fundamental en la biología de dos de los principales centros de señalización en el embrión que ayudan a controlar el desarrollo de las extremidades y del sistema nervioso.
Por su parte, el trabajo del CNIO, liderado por Manuel Serrano y el investigador postdoctoral Daniel Muñoz-Espín, identifica procesos idénticos en dos tejidos más del embrión implicados en la formación de los riñones y el oído.
La diferencia entre ellos es que se centran en diferentes componentes del desarrollo embrionario: un tejido que funciona como riñón y una estructura del oído interno (CNIO), y el cierre del tubo neural y la estructura responsable de la formación de los dedos (CRG).
“El hallazgo que hemos comprobado, común en los dos laboratorios, es que hay un gen (P21) que activa la senescencia en estas estructuras”, explica a SINC Muñoz-Espín. “Al eliminar este gen, se pierde gran parte de la senescencia”.
“A medida que crece el embrión sus tejidos van cambiando, la senescencia se ocupa de apagar las células que ya no son necesarias, una especie de proceso de reciclaje”, apunta el investigador del CNIO.
Una adaptación evolutiva
Ambos estudios muestran cómo la eliminación de células senescentes realizada por los macrófagos de forma coordinada desempeña un papel clave en la remodelación de los tejidos durante el desarrollo, fundamental para la formación normal de un embrión.
Curiosamente, los tejidos en los que los investigadores del centro catalán describen la senescencia están entre aquellos más afectados por defectos congénitos de nacimiento, sugiriendo que una investigación de los mecanismos que regulan la senescencia en el embrión podría ayudar a explicar las causas de algunos problemas en el desarrollo.
Gracias a este nuevo rol, los investigadores sugieren que la senescencia relacionada con el envejecimiento y el cáncer es una adaptación evolutiva de un mecanismo del desarrollo. Pero los autores quieren ser cautos con el hallazgo.
“Por un lado, se ha demostrado que la senescencia protege del cáncer y actúa como un mecanismo de defensa contra el cáncer. Y por otro, siempre se ha relacionado con una causa del envejecimiento”, subraya Muñoz-Espín.
“Pero nuestra opinión es que atribuir a la senescencia un papel en el envejecimiento sería como pensar que los bomberos causan los incendios. Es más, la senescencia sería un proceso fundamentalmente beneficioso para el organismo adulto que serviría para eliminar las células dañadas”, concluye.
Referencias bibliográficas: Mekayla A Storer, Alba Mas, Alexandre Robert-Moreno, Matteo Pecoraro, M Carmen Ortells, Valeria Di Giacomo, Reut Yosef, Noam Pilpel, Valery Krizhanovsky, James Sharpe, Bill Keyes. “Senescence is a developmental mechanism that contributes to embryonic growth patterning”. Cell (2013). DOI: http://dx.doi.org/10.1016/j.cell.2013.10.041
El trabajo se ha llevado a cabo desde el Centro de Regulación Genómica en Barcelona y ha sido financiado por el Ministerio de Economía y Competitividad, el CRG y las becas para estudiantes de doctorado CRG-“La Caixa”.
Daniel Muños-Espín, Marta Cañamero, Antonio Maraver, Gonzalo Gómez-López, Julio Contreras, Silvia Murillo-Cuesta, Alfonso Rodríguez-Baeza, Isabel Varela-Nieto, Jesús Ruberte, Manuel Collado, Manuel Serrano. “Programmed cell senescence during mammalian embryonic development”. Cell (2013). DOI: http://dx.doi.org/10.1016/j.cell.2013.10.019
El trabajo ha contado con financiación del Ministerio de Economía y Competitividad, la Comunicad de Madrid, el European Research Council, la Fundación Botín, la Fundación Ramón Areces y la Fundación AXA.
Fuente: Sinc. Aportado por Eduardo J. Carletti
Más información:
- Dibujan el mapa de los interruptores genéticos que modelan el rostro
- Evolución en la morfología y fisiología de los seres vivos tienen mecanismos genéticos diferentes
- Google Earth para células: permite a los biólogos ampliar o reducir la imagen
- Un aparato crea modelos de bebés no nacidos
- Científicos hacen crecer dientes a partir de células humanas y de ratón
- Las células madre pueden sobrevivir a la muerte y volver a ser funcionales
- Las células madre podrían ser el estado «por defecto» de la células
- Las células madre están en constante agitación genética