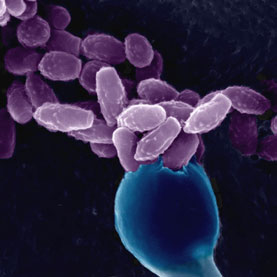
Los hongos criptococos han desarrollado mecanismos para eludir a sus depredadores protistas, dándoles una ventaja accidental sobre las similares células inmunes de los seres humanos, marsopas y otros mamíferos
 Durante mucho tiempo han sido comunes los brotes repentinos de hongos entre las plantas, y más recientemente, en los animales. Un reciente brote entre los humanos en el noroeste del Pacífico plantea la preocupante posibilidad de que tampoco somos inmunes.
Durante mucho tiempo han sido comunes los brotes repentinos de hongos entre las plantas, y más recientemente, en los animales. Un reciente brote entre los humanos en el noroeste del Pacífico plantea la preocupante posibilidad de que tampoco somos inmunes.
El brote está en curso, pero, a pesar de las apariencias, Cryptococcus gattii no existe para ser una peste para nosotros. El hongo prefiere vivir en el suelo y en los árboles, donde subsiste felizmente en la materia en descomposición. Entonces, ¿cómo puede un organismo que parece disfrutar de una vida plena y rica en las plantas y la suciedad haberse adaptado, posiblemente, para vivir dentro de los seres humanos? Parece que la respuesta es: puede ser un accidente de la evolución.
La vida en la naturaleza no es todo Sol y rosas podridas para C. gattii. «Los microorganismos se encuentran en una constante lucha por el territorio, las fuentes de alimentos, por su lugar en la comunidad microbiana», dice Karen Bartlett, de la Universidad de British Columbia, que es experta en el comportamiento de los suspensiones de partículas biológicas. Las levaduras tienen muchos depredadores, y entre ellos se encuentran las amibas como formidables enemigos. Estos protistas deslizan su camino a través del suelo y el agua del mundo, tragándose y digiriendo pequeñas presas. Para evitar la aniquilación amebiana, las especies de Cryptococcus han desarrollado mecanismos para eludir a sus posibles depredadores, como una cobertura seca y resistente a la digestión, pigmentos que los protegen de la radiación UV y la capacidad de sobrevivir al ser tragado por los depredadores.
Esos mismos mecanismos permite a la levadura evadir un tipo de célula humana inmune que se ve y actúa como una ameba (en otros animales se encuentran también células similares). Las llamamos macrófagos. Los macrófagos, que pueden compartir raíces evolutivas con las amebas de vida libre, hacen prácticamente el mismo trabajo en los seres humanos que las amebas hacer en el entorno: se arrastran por allí comiendo cosas. En nuestro caso, esas cosas son pedacitos de desperdicios y microbios, que ingieren y matan con sus enzimas digestivas, al igual que las amebas silvestres. «Si no se conoce la diferencia, uno pensaría que son amebas», dice Bartlett.
Y al parecer, tampoco lo saben los Cryptococcus. Los macrófagos recorren la superficie de nuestros pulmones, limpiando los muchos objetos extraños que llegan allí pero no pertenecen al sitio. En las personas y los animales vulnerables las especies de Cryptococcus son igual de hábiles en engañar a los macrófagos como lo son de sus atacantes en el suelo. Y utilizan los mismos métodos, al menos en el laboratorio.
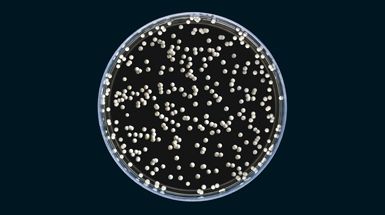
C. gattii no sólo puede matar a los macrófagos, también pueden esconderse entre ellos. Si se ingiere, las células de hongos resisten la digestión mientras se esconden de los anticuerpos, células T, y otros componentes del sistema inmune, convirtiendo efectivamente a un macrófago en un caballo de Troya microbiano. Los macrófagos viajan extensivamente a través del cuerpo y pueden atravesar la barrera hematoencefálica. Si una célula de hongo encuentra su camino desde el pulmón al cerebro a través de un fago o por otras vías, «eso es una muy mala noticia», dice Bartlett, «porque una vez que entra en el sistema nervioso central, está en el cielo. Cuenta con todos los azúcares que quiere para ser capaz de proliferar rápidamente. «Cuando Cryptococcus mata, por lo general es debido a una infección cerebral, como ha sucedido.
Hay otras razones por las que Cryptococcus tiene un trabajo fácil cuando nos infecta. A diferencia de la gran mayoría de los hongos, puede sobrevivir a los 37 grados Celsius de la temperatura del cuerpo humano. Y tiene una capa de polisacáridos resistente que no sólo la ayuda a prevenir que se seque en el medio ambiente, sino que también ayuda a protegerla de los macrófagos. Por último, su exterior contiene melanina, el mismo pigmento que colorea la piel humana, que lo protege de la radiación UV así como inhibe la acción digestiva de los macrófagos. «Todas estas cosas son los mecanismos de protección que le ha permitido establecerse en el medio ambiente», dice Bartlett, «y desafortunadamente, estos mismos mecanismos de protección lo convierten en un patógeno para nosotros.»
Sorprendentemente, este no es un fenómeno aislado. La Legionella pneumophila, la causa bacteriana de la enfermedad del legionario, vive simbióticamente dentro amebas acuáticas silvestres y de manera similar infecta a los macrófagos humanos por error cuando las víctimas inhalan. Arturo Casadevall, presidente del Departamento de Microbiología e Inmunología y director del Centro de Ciencias de Inmunología del Colegio de Medicina Albert Einstein, quien ha estado estudiando los Cryptococcus durante más de 20 años, ha comparado el fenómeno con un juego de cartas, donde los microbios del suelo están jugando para la supervivencia, pero por casualidad, un par de manos confieren «la virulencia accidental» en otros anfitriones.
«La virulencia no es su negocio», dice Casadevall. «Su negocio es la supervivencia. Pero las mismas presiones que están permitiendo que sobrevivan resultan en rasgos que les da la capacidad de sobrevivir en los mamíferos.»
Fuente: Scientific American. Aportado por Eduardo J. Carletti
Más información:
- El posible "eslabón perdido" del reino de los hongos
- Hongos alimentados por la radiación
- Científicos demuestran que los priones «sin vida» son capaces de cambios evolutivos y adaptación
- Antigua pintura prehistórica está literalmente viva
- Los organismos sin cerebro que logran navegar
- Secuencian genes de un eucariota que no encaja con ninguno de los demás
- Formas de vida: un protozoo interpreta de otro modo el código genético
- ¿Qué mecanismo puede producir una evolución a saltos?
- Datos sobre las mutaciones del virus de la gripe aviar vetadas por EEUU salen a la luz
- Descifran el genoma de más de 4.600 tumores