Imagine el cerebro como una central de conmutación gigante cubierta con miles de botones, perillas, diales y palancas que controlan aspectos de nuestro pensamiento, emociones, comportamiento y memoria.
Durante más de un siglo, los neurocientíficos han estado encendiendo y apagando metódicamente estos interruptores, solos o en combinación, para tratar de comprender cómo funciona la máquina en su conjunto. Pero esto es más fácil decirlo que hacerlo. Los circuitos celulares que controlan la mente y el comportamiento se enredan en la masa opaca y gelatinosa de nuestro tejido cerebral y no vienen con prácticos interruptores de encendido/apagado para facilitar la ingeniería inversa.
Ahora, los científicos del Instituto de Neurociencias Wu Tsai de la Universidad de Stanford han desarrollado la primera técnica no invasiva para controlar circuitos cerebrales específicos en el comportamiento de animales a distancia. La herramienta tiene el potencial de resolver una de las mayores necesidades insatisfechas en neurociencia: una forma de probar de manera flexible las funciones de células cerebrales particulares y circuitos profundos en el cerebro durante el comportamiento normal, como ratones que socializan libremente entre sí.
La investigación fue publicada en marzo de 2022 en Nature Biomedical Engineering por Guosong Hong y sus colegas de Stanford y la Universidad Tecnológica Nanyang de Singapur. Hong es un becario de la facultad del Instituto de Neurociencias Wu Tsai y profesor asistente de ciencia e ingeniería de materiales en la Escuela de Ingeniería de Stanford que utiliza su experiencia en química y ciencia de materiales para diseñar herramientas y materiales biocompatibles para avanzar en el estudio del cerebro.
La técnica recientemente publicada se basa en los cimientos establecidos por la optogenética, una técnica desarrollada por primera vez en Stanford por Karl Deisseroth, afiliado de Wu Tsai Neuro, y colaboradores que introduce proteínas de algas sensibles a la luz en las neuronas para permitir que los investigadores las activen o desactiven en respuesta a diferentes colores de luz.
«La optogenética ha sido una herramienta transformadora en la neurociencia, pero existen limitaciones sobre lo que se puede hacer con las técnicas existentes, en parte debido a su dependencia de la luz en el espectro visible», dijo Hong. «El cerebro es bastante opaco a la luz visible, por lo que llevar la luz a las células que desea estimular normalmente requiere implantes ópticos invasivos que pueden causar daños en los tejidos y conexiones de fibra óptica montadas en el cráneo que dificultan el estudio de muchos tipos de comportamiento natural. »
Pensando como científico de materiales sobre las formas de superar estos desafíos, Hong reconoció que los tejidos biológicos, incluido el cerebro e incluso el cráneo, son esencialmente transparentes a la luz infrarroja, lo que podría hacer posible que la luz entre mucho más profundo en el cerebro.
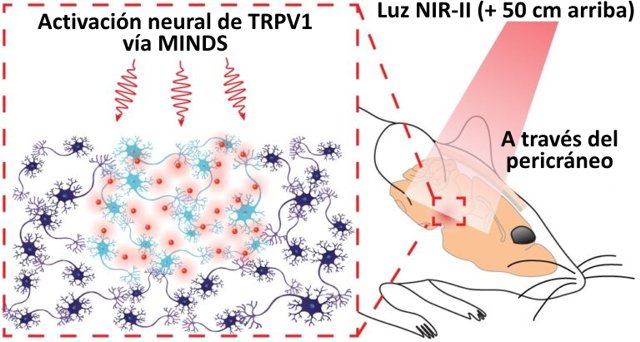
Dado que las herramientas optogenéticas existentes no responden a la luz infrarroja, el equipo de Hong recurrió a una molécula que evolucionó para detectar la otra forma del infrarrojo: el calor. Al equipar de forma artificial neuronas específicas en el cerebro del ratón con una molécula sensible al calor llamada TRPV1, su equipo descubrió que era posible estimular las células modificadas al hacer brillar luz infrarroja a través del cráneo y el cuero cabelludo a una distancia de hasta un metro.
TRPV1 es el sensor de calor molecular que nos permite sentir el dolor relacionado con el calor, así como el ardor picante de un pimiento, cuyo descubrimiento condujo al Premio Nobel de Medicina 2021. Un receptor similar les da a las serpientes de cascabel y otras víboras de pozo la «visión de calor» que les permite cazar presas de sangre caliente en la oscuridad, y un estudio reciente logró darles a los ratones la capacidad de ver en el espectro infrarrojo al agregar TRPV1 a sus células cónicas retinales. .
La nueva técnica también se basa en una molécula «transductora» diseñada que se puede inyectar en regiones específicas del cerebro para absorber y amplificar la luz infrarroja que penetra a través del tejido cerebral. Estas partículas a nanoescala, denominadas MINDS (por Macromolecular Infrared Nanotransducers for Deep-brain Stimulation o «nanotransductores infrarrojos macromoleculares para la estimulación cerebral profunda» en español), funcionan un poco como la melanina en nuestra piel que absorbe los dañinos rayos UV del sol, y están elaborados a partir de polímeros biodegradables que se utilizan para producir orgánicos células solares y LED.
«Primero intentamos estimular las células solo con los canales TRPV1 y no funcionó en absoluto», dijo Hong. «Resulta que las serpientes de cascabel tienen una forma mucho más sensitiva de detectar señales infrarrojas de lo que podríamos manejar en el cerebro del ratón. Afortunadamente, teníamos la ciencia de los materiales para ayudarnos».
El equipo de Hong demostró por primera vez su técnica agregando canales TRPV1 a las neuronas en un lado de la corteza motora del ratón, una región que orquesta los movimientos del cuerpo, e inyectando moléculas MINDS en la misma región. Al principio, los ratones exploraron sus recintos al azar, pero cuando los investigadores encendieron una luz infrarroja sobre el recinto, los ratones inmediatamente comenzaron a caminar en círculos, impulsados por la estimulación unilateral de su corteza motora.
«Ese fue un gran momento cuando supimos que esto iba a funcionar», dijo Hong. «Por supuesto, fue solo el comienzo de validar y probar lo que esta tecnología podía hacer, pero a partir de ese momento estaba seguro de que teníamos algo».
En otro experimento clave, los investigadores demostraron que MINDS podría permitir la estimulación infrarroja de las neuronas a través de toda la profundidad del cerebro del ratón. Insertaron canales TRPV1 en las neuronas que expresan dopamina de los centros de recompensa del cerebro, que se encuentran cerca de la base del cerebro en ratones, seguidos de una inyección de MINDS en la misma región. Luego colocaron una luz infrarroja enfocada sobre uno de los tres brazos de un laberinto de brazos radiales estándar y mostraron que los ratones se volvieron «adictos» a la luz infrarroja invisible que hacía cosquillas en sus neuronas de dopamina, pasando casi todo el tiempo en el laberinto bajo sus haces.
Este experimento demostró que la nueva técnica hace posible estimular las neuronas en cualquier parte del cerebro a través del cuero cabelludo y el cráneo intactos, casi sin la dispersión de la luz que lo haría imposible con la luz en el espectro visual. Sorprendentemente, esto funcionó incluso cuando el haz de luz infrarroja se colocó hasta un metro por encima de las cabezas de los animales.
Hong ve aplicaciones inmediatas de la técnica para el creciente movimiento en neurociencia para estudiar los circuitos cerebrales involucrados en el comportamiento social natural en ratones para comprender mejor los sistemas que subyacen a la cognición social en humanos.
«Al igual que nosotros, los ratones son una especie social, pero estudiar el comportamiento natural de un animal dentro de un grupo social es un desafío con una cuerda de fibra óptica montada en la cabeza», dijo Hong. «Este enfoque hace posible por primera vez modular neuronas y circuitos específicos en animales que se comportan libremente. Uno podría hacer brillar una luz infrarroja invisible sobre un recinto con ratones coalojados para estudiar las contribuciones de células y circuitos particulares al comportamiento de un animal dentro del entorno de un grupo social.»
Hong y sus colaboradores continúan refinando la técnica para que sea más simple y fácil de implementar, dijo. «En el futuro, nos gustaría combinar nuestro enfoque actual de dos etapas en una sola máquina molecular, tal vez mediante la codificación de algún pigmento absorbente de infrarrojos en las propias neuronas que expresan TRP».
El trabajo es uno de varios enfoques en los que Hong está involucrado para hacer posible que los investigadores, y quizás algún día los médicos, modulen de forma no invasiva los circuitos neuronales en todo el cerebro. Por ejemplo, Hong y sus colegas también están desarrollando microesferas nanoscópicas que pueden convertir haces de ultrasonido enfocados en luz, y que pueden inyectarse directamente en el torrente sanguíneo, lo que hace posible apuntar optogenéticamente a células en cualquier parte del cerebro y cambiar este objetivo a voluntad dentro de un solo experimento.
«Los enfoques convencionales de neuromodulación nos dieron la capacidad de activar algunos de los interruptores a la vez en el cerebro para ver qué hacen los diferentes circuitos», dijo Hong. «Nuestro objetivo es llevar estas técnicas un paso más allá para brindarnos un control preciso sobre todo el panel de control al mismo tiempo».
Esta investigación fue financiada por una subvención del Instituto de Neurociencias Wu Tsai en Stanford, Stanford Bio-X y una beca interdisciplinaria de posgrado de Stanford; por una subvención de puesta en marcha de la Universidad Tecnológica de Nanyang y el Fondo de Investigación Académica del Ministerio de Educación de Singapur; y por la Fundación Nacional de Ciencias de EE. UU. (NSF), el Instituto Nacional sobre el Envejecimiento de los NIH, la Fundación Rita Allen y la Fundación para la Atrofia Muscular Espinal.
________________________________________
Fuente de la historia: Materiales proporcionados por la Escuela de Ingeniería de la Universidad de Stanford . Original escrito por Nicholas Weiler.
Referencia de la publicación: Xiang Wu, Yuyan Jiang, Nicholas J. Rommelfanger, Fan Yang, Qi Zhou, Rongkang Yin, Junlang Liu, Sa Cai, Wei Ren, Andrew Shin, Kyrstyn S. Ong, Kanyi Pu, Guosong Hong. Tether-free photothermal deep-brain stimulation in freely behaving mice via wide-field illumination in the near-infrared-II window. Nature Biomedical Engineering, 2022; DOI: 10.1038/s41551-022-00862-w
Noticias relacionadas: